Pruebas genéticas: indicaciones, incertidumbres y excesos
Cuándo es necesario realizar pruebas
genéticas, cómo interpretarlas, cómo prevenir los efectos secundarios de
una información inútil o no deseada

Autor: hristopher Semsarian, professor, Jodie Ingles,
researcher Fuente: BMJ 2017; 358 doi: https://doi.org/10.1136/bmj.j4101 A clinical approach to genetic testing for non-specialists
Lo que necesita saber
|
| Una madre de dos hijos, de 32 años de edad, se presenta ante su médico general después de la muerte súbita de su hermano de 29 años previamente saludable. El examen postmortem identificó una cardiomiopatía hereditaria subyacente y el análisis genético del ADN postmortem encontró la variante Arg502Trp en el gen MYBPC3, una causa común de cardiomiopatía hipertrófica1. Dado el riesgo familiar, se aconsejó a los familiares que buscaran atención médica. La mujer plantea preguntas, incluyendo cuál es el riesgo de la enfermedad para sí misma, para sus dos hijos, hermanos y padres, cuál es el significado del resultado del gen y si la familia debería someterse a pruebas genéticas. Le preocupa prevenir cualquier muerte repentina en su familia. Aquí ofrecemos una visión general de los principios básicos de las pruebas genéticas y cómo se pueden aplicar en un entorno clínico general. |
La herencia de rasgos procede de experimentos con guisantes realizados por Mendel en el siglo XIX, donde demostró que los padres aportan un alelo cada uno a su descendencia, con uno "dominando" al otro. Este principio es la base de la genética médica moderna, donde las enfermedades mendelianas se heredan en las familias como rasgos autosómicos dominantes, recesivos o ligados al cromosoma X (cuadro 1). Además de la complejidad en los seres humanos, también se observa una penetrancia incompleta, es decir, la falta de expresión de un rasgo y la heterogeneidad clínica, donde se produce variabilidad en las características clínicas debido a factores ambientales y a otros factores genéticos.
Los rasgos genéticos complejos son el resultado de numerosas variantes genéticas, así como de influencias ambientalesMientras que la herencia mendeliana se refiere a la herencia de una sola variante (cambio del ADN), los rasgos genéticos complejos son el resultado de numerosas variantes genéticas, así como de influencias ambientales que aumentan el riesgo de desarrollar una enfermedad. Las pruebas genéticas se pueden utilizar en cualquiera de los dos escenarios, y aquí discutiremos brevemente el valor y los retos potenciales de ambos.
Cuadro 1: Patrones comunes de herencia de enfermedades genéticas
|
El ADN se puede obtener de un individuo a través de una muestra de sangre o colección de otro tipo celular tal como tejido o saliva. Las pruebas genéticas son un proceso en el que se secuencia el ADN para buscar cambios en la composición genética. Juega un papel valioso en el manejo familiar de las enfermedades mendelianas y con la aparición de tecnologías de secuenciación de próxima generación2, hemos visto una rápida evolución en la forma en que se pueden aplicar las pruebas genéticas en la clínica (recuadro 2).
Cuadro 2: Principios de las pruebas genéticas para las enfermedades mendelianas
|
| Enfermedad | Monogénica | Multigénica | Compleja |
| Ejemplo | Hungtinton | Miocardiopatía hipertrófica | Enfermedad coronaria |
| Fenotipo | Corea, distonía, declive cognitivo | HVI, alteraciones diastólicas | Angor, disnea, ATC |
| Genotipo | Citocina-adenina-guanina | Genes relacionados con sarcómeros | Variantes relacionadas con dislipidemia, trombosis, inflamación |
| Patrón herencia | Autosómica dominante | Autosómica dominante | Herenica poligénica |
El consentimiento informado para las pruebas genéticas es importante, y la demanda de asesoramiento genético está creciendo. Los consejeros genéticos son profesionales de la salud o enfermeras calificadas, capacitados para comunicar con sensibilidad información genética y ayudar a las familias a tomar decisiones médicas informadas que reflejen mejor sus propias preferencias personales, valores y creencias.
¿Cuál es el valor de las pruebas genéticas?
El mayor valor de las pruebas genéticas es para aclarar el riesgo de los familiares asintomáticosLas pruebas genéticas pueden ser particularmente útiles para los pacientes que podrían estar en riesgo de desarrollar enfermedades mendelianas. El primer paso suele ser identificar la causa genética subyacente en un individuo que tiene enfermedad clínica evidente. Un resultado genético puede ayudar a aclarar el diagnóstico, guiar el tratamiento y las estrategias de prevención [4], y en algunos casos informar acerca del pronóstico. En la mayoría de los casos, las pruebas genéticas solo deben considerarse después de realizar una evaluación clínica completa y después de tomar una historia familiar detallada que abarca tres generaciones. Tales factores son críticos en la determinación de la probabilidad previa a la prueba de encontrar un resultado significativo y clínicamente útil.5
El mayor valor de las pruebas genéticas es para aclarar el riesgo de los familiares asintomáticos.6 Una vez que se identifica una variante causal en un individuo, esta prueba puede identificar la presencia o ausencia de esa variante en otros miembros de la familia. Técnicamente, esta es una prueba más simple. Dependiendo de la naturaleza de la enfermedad que se está probando, puede haber consideraciones éticas, legales y sociales importantes y por lo tanto las pruebas sólo deben considerarse en el contexto de un amplio asesoramiento genético antes y después del examen.
Nuestra paciente de 32 años necesitaría considerar si quiere saber si está en riesgo de desarrollar una afección cardíaca, cómo esto podría afectar las solicitudes de seguro, si haría las pruebas a sus hijos y cómo podría abordar este tema con ellos.
El beneficio de las pruebas genéticas para enfermedades complejas no es tan claro. La tendencia creciente para las pruebas genéticas directas al consumidor significa que muchas personas sin condiciones hereditarias discernibles tendrán pruebas y se les informará que tienen un mayor riesgo de ciertas enfermedades. El valor de esto es cuestionable dado que existen muchos factores no probados que probablemente contribuirán al riesgo de enfermedad, incluyendo variantes en otros genes y el medio ambiente.7 En tal escenario, esta forma de prueba de ADN no se recomienda sin consejo genético y los individuos deben entender que cualquier resultado obtenido podría no detectar o predecir una enfermedad.
¿Cuáles son los desafíos de las pruebas genéticas?
Las variantes identificadas a partir de pruebas genéticas se clasifican en función de su probabilidad de ser la causa de un fenotipo. La naturaleza probabilística del resultado genético significa que la evidencia se usa para evaluar a una variante en una clasificación que varía de patogénica (causante) a benigna (no causante) .910 Es importante destacar que las variantes consideradas como patógenas pueden usarse para aclarar el riesgo en miembros de la familia. Cuando no hay pruebas suficientes, se hace una afirmación de variante de significación “incierta”, lo que genera una incertidumbre potencial tanto para los clínicos asistentes como para sus pacientes.
En nuestro ejemplo, la variante detectada en el hermano fallecido se clasifica como patógena, teniendo el mayor nivel de evidencia de que es la causa de la enfermedad, lo que significa que los miembros de la familia tienen la opción de someterse a pruebas genéticas.
Figura 1 La naturaleza probabilística de las pruebas genéticas
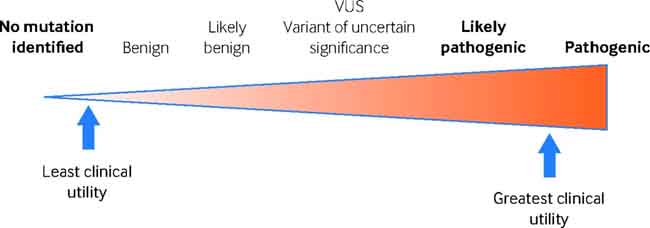
Si bien hay muchos beneficios de las pruebas genéticas, demasiada información genética, en particular para los individuos asintomáticos, tiene el potencial de crear incertidumbre y preocupación, así como los costos incurridos para pruebas clínicas adicionales que podrían ser innecesarias.1314 Esta es una consideración importante para los miembros de la familia en la toma de decisión de someterse o no a la prueba genética para la variante causal en la familia. Si bien es una herramienta valiosa en el manejo de la familia, actualmente hay desafíos para saber qué variantes son la causa de la enfermedad y cuáles son inocentes. Si se utiliza una variante incorrecta para las pruebas en cascada en una familia, el daño potencial puede ser grave.15
¿Qué aprendemos sobre el escenario clínico?
Esta madre de dos hijos de 32 años de edad decidió que preferiría ser proactiva para minimizar el riesgo de cualquier evento cardíaco, tanto por su propia salud como por la de sus hijos. Fue trasladada a una clínica de genética cardíaca especializada donde fue sometida a evaluación clínica, y después de un cuidadoso asesoramiento genético antes de la prueba, optó por realizar pruebas genéticas en cascada. Seis semanas más tarde, su consejero genético le informó que no portaba la variante patogénica Arg502Trp en MYBPC3 y, por lo tanto, no corría el riesgo de desarrollar cardiomiopatía hipertrófica, y sus hijos tampoco corrían riesgo. Esto viene como alivio, y ahora puede llorar por su hermano, sabiendo que ella y sus hijos no es probable que sufren el mismo destino.
Mientras que las pruebas genéticas para una enfermedad mendeliana pueden tener un valor enorme, incluso en este caso se debe tomar cuidado para evitar un daño innecesario. A medida que las tecnologías genéticas continúan avanzando y el acceso a todas las formas de pruebas genéticas se vuelve más común, todos los médicos de atención primaria necesitarán entender los principios básicos del manejo de estos pacientes para asegurar un cuidado óptimo.
No hay comentarios:
Publicar un comentario